近日,太阳成集团tyc9728佟振合院士团队徐政虎课题组在对映选择性合成β-内酰胺的研究中取得突破进展,相关论文连续发表于化学国际权威期刊《德国应用化学》。公司博士生齐佳霖为第一作者,徐政虎教授为通讯作者,太阳娱乐集团app下载化学与化工院为第一通讯单位。
β-内酰胺作为以青霉素为代表的抗生素的核心骨架,在化学、生物学、医学、药学等领域受到广泛关注。在有机合成上β-内酰胺是一类重要的合成子,用于合成β-氨基酸,比如被用于合成Taxol的边链。发展新的不对称催化反应构建手性多功能化的β-内酰胺结构,对于有机合成以及进一步发展新型抗生素,应对抗生素危机都有重要的意义。
传统的Kinugasa反应可以实现铜催化的端炔和硝酮的环加成/异构化反应得到β-内酰胺,在课题组前期“中断点击化学”(Angew. Chem. Int. Ed, 2016, 55, 649)的工作基础上,发展了一种新的“中断Kinugasa反应”的策略(Interrupted Kinugasa Reaction),将端炔、硝酮和硫亲电试剂的三组分快速组装成多取代的硫功能化手性β-内酰胺(图1)。该反应采用带六个甲氧基取代的边臂双噁唑啉(HM-BOX)结合一价铜催化剂,利用硫亲电试剂捕获Kinugasa反应关键手性四元烯醇铜中间体M1,阻断传统的质子化反应,合成了α-硫官能化的手性β-内酰胺。该反应在温和条件下,以良好的收率、非对映选择性和对映选择性,一步高效构建了含有两个连续手性中心的含硫手性β-内酰胺。这是首例不对称的三组分中断Kinugasa反应的报道,该方法为构建官能化的手性β-内酰胺提供了一种简便的方法。论文近期发表于化学国际权威期刊《德国应用化学》(Angew. Chem. Int. Ed. 2021, 60, 4561)。
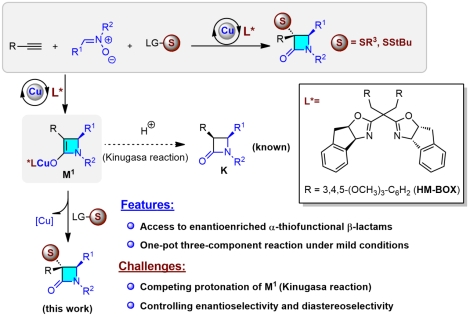
图1 Cu(I)催化的不对称中断Kinugasa反应合成含硫手性β-内酰胺
含全碳季碳手性中心的构建一直是有机合成化学的挑战,课题组延续此“中断Kinugasa反应”的策略,进一步发展了Cu/Pd协同催化多组分反应模块化合成α-全碳季碳手性β-内酰胺。该反应的创新性在于原位形成的两个催化量的瞬态有机金属中间体的立体选择性偶联,以良好的收率、非对映选择性和对映选择性,一步高效构建了α-全碳季碳手性β-内酰胺(图2)。论文近期在线发表于《德国应用化学》(Angew. Chem. Int. Ed. 2021, anie.202100601)。该系列成果对于有机合成,药物化学尤其是单环抗生素的发展具有重要的价值。
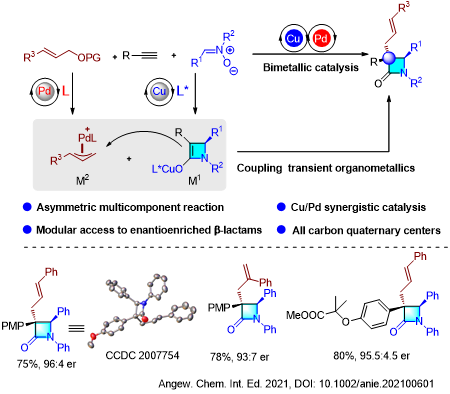
图2 不对称中断Kinugasa反应合成α-全碳季碳手性β-内酰胺
以上研究工作得到了国家自然科学基金、山东省重大基础研究项目,太阳娱乐集团app下载团队建设经费的支持,太阳娱乐集团app下载结构成分与物性测量平台为本工作的顺利开展提供了关键支持。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202013450
https://onlinelibrary.wiley.com/doi/10.1002/anie.202100601